Kromium trivalen (Cr(III), atau Cr3+) diperlukan dalam jumlah kecil dalam metabolisme gula pada manusia. Kekurangan kromium trivalen dapat menyebabkan penyakit yang disebut penyakit kekurangan kromium (chromium deficiency).
Kromium merupakan logam tahan korosi (tahan karat) dan dapat dipoles
menjadi mengkilat. Dengan sifat ini, kromium (krom) banyak digunakan
sebagai pelapis pada ornamen-ornamen bangunan, komponen kendaraan,
seperti knalpot pada sepeda motor, maupun sebagai pelapis perhiasan seperti emas, emas yang dilapisi oleh kromium ini lebih dikenal dengan sebutan emas putih.
Perpaduan Kromium dengan besi dan nikel menghasilkan baja tahan karat.
Sejarah
Ditemukan pada tahun 1797 oleh
Vauquelin, yang membuat logam khrom pada tahun berikutnya. Khrom adalah
logam berwarna abu-abu, berkilau, keras sehingga memerlukan proses
pemolesan yang cukup tinggi.
Isotop
 |
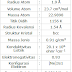
| Sekilas info tentang Krom |
Kromium secara alamiah terdiri dari tiga isotop stabil; 52Cr, 53Cr dan 54Cr dengan 52Cr paling banyak ditemukan (83,789% keberadaan alamiah). 19 radioisotop telah dikarakterisasi di mana yang paling stabil adalah 50Cr dengan waktu paruh (lebih dari) 1,8×1017 tahun, dan 51Cr dengan waktu paruh 27,7 hari. Isotop radioaktif
sisanya memiliki waktu paruh kurang dari 24 jam dan sebagian besar
dengan waktu paruh kurang dari 1 menit. Unsur ini juga mempunyai dua meta state.
Sumber
Bijih
utama khrom adalah khromit, yang ditemukan di Zimbabwe, Rusia, Selandia
Baru, Turki, Iran, Albania, Finlandia, Republik Demokrasi Madagaskar,
dan Filipina. Logam ini biasanya dihasilkan dengan mereduksi khrom
oksida dengan aluminum.
Kegunaan
Khrom
digunakan untuk mengeraskan baja, pembuatan baja tahan karat dan
membentuk banyak alloy (logam campuran) yang berguna. Kebanyakan
digunakan dalam proses pelapisan logam untuk menghasilkan permukaan
logam yang keras dan indah dan juga dapat mencegah korosi. Khrom
memberikan warna hijau emerald pada kaca. Khrom juga luas digunakan
sebagai katalis.
Industri refraktori menggunakan khromit untuk
membentuk batu bata, karena khromit memiliki titik cair yang tinggi,
pemuaian yang relatif rendah dan kstabilan struktur kristal.
Senyawa
Senyawa
komponen khrom berwarna. Kebanyakan senyawa khromat yang penting adalah
natrium dan kalium, dikromat, dan garam dan ammonium dari campuran
aluminum dengan khrom . Dikhromat bersifat sebagai zat oksidator dalam
analisis kuantitatif, juga dalam proses pemucatan kulit.
Senyawa
lainnya banyak digunakan di industri; timbal khromat berwarna kuning
khrom, merupakan pigmen yang sangat berharga. Senyawa khrom digunakan
dalam industri tekstil sebagai mordan atau penguat warna. Dalam industri
penerbangan dan lainnya,senyawa khrom berguna untuk melapisi aluminum.
Kromium adalah salah satu logam transisi, dalam grup 6. Kromium(0) mempunyai konfigurasi elektronik 4s13d5, mendapatkan energi lebih rendah dari konfigurasi spin tinggi. Berikut adalah diagram Pourbaix bagi kromium dalam air murni, asam perklorat atau natrium hidroksida: 350px
Kromium(III)

Kromium(III) klorida heksahidrat ([CrCl2(H2O)4]Cl·2H2O)
Ada banyak senyawa kromium(III). Kromium(III) dapat diperoleh dengan melarutkan unsur kromium dalam asam seperti asam klorida atau asam sulfat.
Kromium(VI)
Senyawa-senyawa kromium(VI) merupakan oksidan kuat pada pH rendah atau netral. Yang paling penting adalah anion kromat (CrO42-) dan dikromat (Cr2O72-), yang berada dalam keseimbangan:
- 2 [CrO4]2- + 2 H+
 [Cr2O7]2- + H2O
[Cr2O7]2- + H2O
Kromium(VI) halida yang dikenal termasuk heksafluorida CrF6 dan kromil klorida (CrO2Cl2).
Kromium(V) dan kromium(IV)
Status oksidasi +5 hanya terjadi pada beberapa senyawa tetapi
merupakan intermediat dalam banyak reaksi yang melibatkan oksidasi oleh
kromat. Senyawa-senyawa kromium(IV) (dalam status oksidasi +4) agak
lebih banyak daripada kromium(V). Tetrahalida, CrF4, CrCl4, dan CrBr4, dapat diproduksi dengan mereaksikan trihalida (CrX3) dengan halogen pada suhu tinggi. Senyawa-senyawa ini sangat peka terhadap reaksi disproporsionasi dan tidak stabil dalam air.
Kromium(II)
Ada banyak senyawa kromium(II), termasuk kromium(II) klorida, CrCl2, yang stabil dalam air dan dapat dibuat dari reduksi kromium(III) klorida dengan seng. Larutan biru cerah yang dihasilkan hanya stabil pada pH netral.
Kromium(I)
Kebanyakan senyawa Cr(I) diperoleh dari oksidasi kompleks oktahedral
Cr(0) yang kaya elektron. Kompleks-kompleks Cr(I) yang lain mengandung
ligand siklopentadienil. Sebagaimana dibuktikan dari difraksi sinar X, ikatan lipat lima Cr-Cr (dengan panjang 183,51(4) pm) juga telah dibahas.
Kromium(0)
Banyak dikenal senyawa kromium(0), kebanyakan adalah derivatif dari kromium heksakarbonil atau bis(benzene)chromium.
Keberadaan
Kromium merupakan unsur terbanyak dalam kulit bumi ke-22 dengan konsentrasi rata-rata 100 ppm. Senyawa-senyawa kromium ditemukan dalam lingkungan, karena erosi
batu-batuan yang mengandung kromium dan dapat didistribusikan oleh
ledakan gunung berapi. Konsentrasi dalam tanah berkisar antara 1 sampai
300 mg/kg, dalam air laut antara 5 sampai 800 µg/liter, dan dalam sungai
serta danau 26 µg/liter sampai 5.2 mg/liter. Kromium diperoleh dari tambang dalam bentuk batu logam (ore) kromit (FeCr2O4). Sekitar dua perlima batu kromit dan konsentratnya di dunia diproduksi di Afrika Selatan, sedangkan Kazakhstan, India, Rusia, dan Turki
juga merupakan produsen penting. Deposit kromit yang belum tergali
masih banyak, tetapi secara geografis terpusat di Kazakhstan dan Afrika
bagian selatan.
Penanganan
Senyawa Khrom beracun dan harus ditangani dengan peralatan keselamatan kerja yang layak.