HCl + NaOH → NaCl + H2O
Asam Basa Garam dapur Air
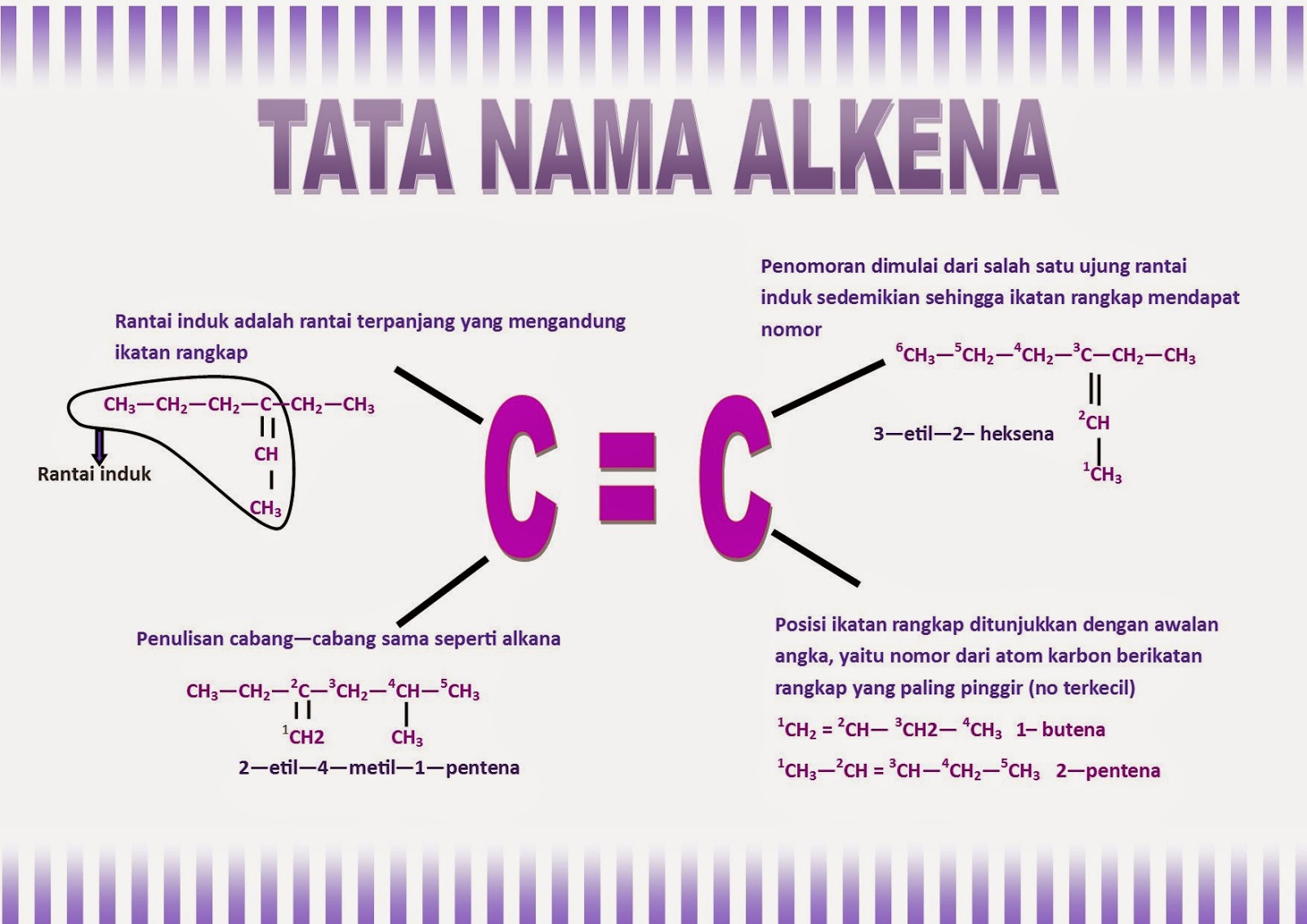
Reaksi kimia yang dapat menghasilkan garam, antara lain:
• Asam + basa menghasilkan garam + air
• Basa + oksida asam menghasilkan garam + air
• Asam + oksida basa menghasilkan garam + air
• Oksida asam + oksida basa menghasilkan garam
• Logam + asam menghasilkan garam + H2
Beberapa garam yang dikenal:
|
Reaksi penetralan berguna bagi manusia, antara lain produksi asam
lambung (HCl) yang berlebihan dapat dinetralkan dengan
menggunakan senyawa basa Mg(OH)2. Para petani menggunakan reaksi
penetralan agar tanah yang terlalu asam dan tidak baik bagi tanaman
dapat menjadi netral dengan menambahkan senyawa basa Ca(OH)2
atau air kapur. Pasta gigi mengandung basa berfungsi untuk
menetralkan mulut kita dari asam, yang dapat merusak gigi dan
menimbulkan bau mulut.
Garam Dapur/Natrium klorida :
Natrium klorida, juga dikenal dengan garam dapur, atau halit, adalah senyawa kimia dengan rumus molekul NaCl. Senyawa ini adalah garam yang paling memengaruhi salinitas laut dan cairan ekstraselular pada banyak organisme multiselular. Sebagai komponen utama pada garam dapur, natrium klorida sering digunakan sebagai bumbu dan pengawet makanan.
Sodium Chlorida atau Natrium Chlorida (NaCl) yang dikenal sebagai garam
adalah zat yang memiliki tingkat osmotik yang tinggi. Zat ini pada
proses perlakuan penyimpanan benih recalsitran berkedudukan sebagai
medium inhibitor yang fungsinya menghambat proses metabolisme benih
sehingga perkecambahan pada benih recalsitran dapat terhambat. Dengan
kemampuan tingkat osmotik yang tinggi ini maka apabila NaCl terlarut di
dalam air maka air tersebut akan mempunyai nilai atau tingkat
konsentrasi yang tinggi yang dapat mengimbibisi kandungan air
(konsentrasi rendah)/low concentrate yang terdapat di dalam tubuh benih
sehingga akan diperoleh keseimbangan kadar air pada benih tersebut. Hal
ini dapat terjadi karena H2O akan berpindah dari konsentrasi
yang rendah ke tempat yang memiliki konsentrasi yang tinggi. Hal ini
merupakan hal yang sangat menguntungkan bagi benih recalsitran, karena
sebagaimana kita ketahui benih recalsitran yaitu benih yang memiliki
tingkat kadar air yang tinggi dan sangat peka terhadap penurunan kadar
air yang rendah. Kadar air yang tinggi menyebabkan benih recalsitran
selalu mengalami perkecambahan dan berjamur selama masa penyimpanan atau
pengiriman ketempat tujuan. Namun dengan perlakuan konsentrasi sodium
chlorida (NaCl) maka hal ini dapat teratasi.
Sumber : Wikipedia