Seng (bahasa Belanda: zink), zink, atau timah sari adalah unsur kimia dengan lambang kimia Zn, bernomor atom 30, dan massa atom relatif 65,39. Ia merupakan unsur pertama golongan 12 pada tabel periodik. Beberapa sifat kimia seng mirip dengan magnesiu
Seng (bahasa Belanda: zink), zink, atau timah sari adalah unsur kimia dengan lambang kimia Zn, bernomor atom 30, dan massa atom relatif 65,39. Ia merupakan unsur pertama golongan 12 pada tabel periodik. Beberapa sifat kimia seng mirip dengan magnesiu
Kuningan, yang merupakan aloi tembaga
dan seng, telah lama digunakan paling tidak sejak abad ke-10 SM. Logam
seng tak murni mulai diproduksi secara besar-besaran pada abad ke-13 di
India, manakala logam ini masih belum di kenal oleh bangsa Eropa sampai
dengan akhir abad ke-16. Para alkimiawan membakar seng untuk menghasilkan apa yang mereka sebut sebagai "salju putih" ataupun "wol filsuf". Kimiawan Jerman Andreas Sigismund Marggraf umumnya dianggap sebagai penemu logam seng murni pada tahun 1746. Karya Luigi Galvani dan Alessandro Volta
berhasil menyingkap sifat-sifat elektrokimia seng pada tahun 1800.
Pelapisan seng pada baja untuk mencegah perkaratan merupakan aplikasi
utama seng. Aplikasi-aplikasi lainnya meliputi penggunaannya pada
baterai dan aloi. Terdapat berbagai jenis senyawa seng yang dapat
ditemukan, seperti seng karbonat dan seng glukonat (suplemen makanan), seng klorida (pada deodoran), seng pirition (pada sampo anti ketombe), seng sulfida (pada cat berpendar), dan seng metil ataupun seng dietil di laboratorium organik.
Seng merupakan zat mineral esensial yang sangat penting bagi tubuh.
Terdapat sekitar dua miliar orang di negara-negara berkembang yang
kekurangan asupan seng. Defisiensi ini juga dapat menyebabkan banyak
penyakit. Pada anak-anak, defisiensi ini menyebabkan gangguan
pertumbuhan, memengaruhi pematangan seksual, mudah terkena infeksi,
diare, dan setiap tahunnya menyebabkan kematian sekitar 800.000
anak-anak di seluruh dunia. Konsumsi seng yang berlebihan dapat menyebabkan ataksia, lemah lesu, dan defisiensi tembaga.
Dalam bahasa sehari-hari, seng juga dimaksudkan sebagai pelat seng yang digunakan sebagai bahan bangunan.
Karakteristik
Sifat fisika
 |
| Sekilas info tentang Seng |
Seng merupakan logam yang berwarna putih kebiruan, berkilau, dan bersifat diamagnetik. Walau demikian, kebanyakan seng mutu komersial tidak berkilau. Seng sedikit kurang padat daripada besi dan berstruktur kristal heksagonal.Lehto 1968, hlm. 826
Logam ini keras dan rapuh pada kebanyakan suhu, namun menjadi dapat ditempa antara 100 sampai dengan 150 °C. Di atas 210 °C, logam ini kembali menjadi rapuh dan dapat dihancurkan menjadi bubuk dengan memukul-mukulnya.
Seng juga mampu menghantarkan listrik. Dibandingkan dengan logam-logam
lainnya, seng memiliki titik lebur (420 °C) dan tidik didih (900 °C)
yang relatif rendah. Dan sebenarnya pun, titik lebur seng merupakan yang terendah di antara semua logam-logam transisi selain raksa dan kadmium.
Terdapat banyak sekali aloi yang mengandung seng. Salah satu contohnya adalah kuningan (aloi seng dan tembaga). Logam-logam lainnya yang juga diketahui dapat membentuk aloi dengan seng adalah aluminium, antimon, bismut, emas, besi, timbal, raksa, perak, timah, magnesium, kobalt, nikel, telurium, dan natrium. Walaupun seng maupun zirkonium tidak bersifat feromagnetik, aloi ZrZn2 memperlihatkan feromagnetisme di bawah suhu 35 K.
Keberadaan
 |
| Sfalerit (ZnS) |
Kadar komposisi unsur seng di kerak bumi adalah sekitar 75 ppm
(0,007%). Hal ini menjadikan seng sebagai unsur ke-24 paling melimpah di
kerak bumi.
Tanah mengandung sekitar 5–770 ppm seng dengan rata-ratanya 64 ppm.
Sedangkan pada air laut kadar sengnya adalah 30 ppb dan pada atmosfer
kadarnya hanya 0,1–4 µg/m3.
Unsur ini biasanya ditemukan bersama dengan logam-logam
lain seperti tembaga dan timbal dalam bijih logam. Seng
diklasifikasikan sebagai kalkofil, yang berarti bahwa unsur ini memiliki
afinitas yang rendah terhadap oksigen dan lebih suka berikatan dengan belerang. Kalkofil terbentuk ketika kerak bumi memadat di bawah kondisi atmosfer bumi awal yang mendukung reaksi reduksi. Sfalerit, yang merupakan salah satu bentuk kristal seng sulfida, merupakan bijih logam yang paling banyak ditambang untuk mendapatkan seng karena ia mengandung sekitar 60-62% seng.
Mineral lainnya juga mengandung seng meliputi smithsonit (seng karbonat), hemimorfit (seng silikat), wurtzit (bentuk seng sulfida lainnya), dan hidrozinkit. Terkecuali wurtzit, kesemua mineral ini terbentuk oleh karena proses cuaca seng sulfida primordial.
Total keseluruhan kandungan seng di seluruh dunia adalah sekitar 1,8 gigaton. Hampir sekitar 200 megatonnya dapat diperoleh secara ekonomis pada tahun 2008. Kandungan besar seng dapat ditemukan di Australia, Kanada, dan Amerika Serikat. Berdasarkan laju konsumsi seng sekarang ini, cadangan seng diperkirakan akan habis antara tahun 2027 sampai dengan 2055.
Sekitar 346 megaton seng telah ditambang sepanjang sejarahnya sampai
dengan tahun 2002. Selain itu, diperkirakan pula sekitar 109 megatonnya
masih digunakan.
Isotop
Terdapat lima isotop seng yang dapat ditemukan secara alami. 64Zn merupakan isotop yang paling melimpah (48,63% kelimpahan alami). Isotop ini memiliki waktu paruh yang sangat panjang, 4,3×1018 a, sedemikiannya radioaktivitasnya dapat diabaikan. Demikian pula isotop 70Zn (0,6%) yang berwaktu paruh 1,3×1016 a tidak dianggap sebagai bersifat radioaktif. Isotop-isotop lainnya pula adalah 66Zn (28%), 67Zn (4%) dan 68Zn (19%).
Terdapat pula dua puluh lima radioisotop yang telah berhasil dikarakterisasikan. 65Zn yang berumur paruh 243,66 hari adalah radioisotop yang berumur paling lama, diikuti oleh 72Zn dengan umur paruh 46,5 jam. Seng memiliki 10 isomer inti. 69mZn merupakan isomer yang berumur paruh paling panjang dengan lama waktu 13,76 jam. Superskrip m mengindikasikan suatu isotop metastabil.
Inti isotop metastabil berada dalam keadaan tereksitasi dan akan
kembali ke keadaan dasarnya dengan memancarkan foton dalam bentuk sinar gama. 61Zn memiliki tiga keadaan tereksitasi dan 73Zn memiliki dua keadaan tereksitasi. Sedangkan isotop 65Zn, 71Zn, 77Zn dan 78Zn semuanya hanya memiliki satu keadaan tereksitasi.
Modus peluruhan yang paling umum untuk isotop seng bernomor massa lebih rendah daripada 64 adalah penangkapan elektron. Produk peluruhan dari penangkapan elektron ini adalah isotop tembaga.
- n
30Zn + e− → n
29Cu
Sedangkan modus peluruhan paling umum untuk isotop seng bernomor massa lebih tinggi daripada 64 adalah peluruhan beta, yang akan menghasilkan isotop galium.
- n
30Zn → n
31Ga + e− + νe
Sifat kimiawi
Reaktivitas
Seng memiliki konfigurasi elektron [Ar]3d104s2 dan merupakan unsur golongan 12 tabel periodik. Seng cukup reaktif dan merupakan reduktor kuat. Permukaan logam seng murni akan dengan cepat mengusam, membentuk lapisan seng karbonat, Zn5(OH)6CO3, seketika berkontak dengan karbon dioksida. Lapisan ini membantu mencegah reaksi lebih lanjut dengan udara dan air.
Seng yang dibakar akan menghasilkan lidah api berwarna hijau kebiruan dan mengeluarkan asap seng oksida. Seng bereaksi dengan asam, basa, dan non-logam lainnya. Seng yang sangat murni hanya akan bereaksi secara lambat dengan asam pada suhu kamar. Asam kuat seperti asam klorida maupun asam sulfat dapat menghilangkan lapisan pelindung seng karbonat dan reaksi seng dengan air yang ada akan melepaskan gas hidrogen.
Seng secara umum memiliki keadaan oksidasi +2. Ketika senyawa dengan
keadaan oksidasi +2 terbentuk, elektron pada kelopak elektron terluar s akan terlepas, dan ion seng yang terbentuk akan memiliki konfigurasi [Ar]3d10. Hal ini mengijinkan pembentukan empat ikatan kovalen dengan menerima empat pasangan elektron dan mematuhi kaidah oktet. Stereokimia senyawa yang dibentuk ini adalah tetrahedral dan ikatan yang terbentuk dapat dikatakan sebagai sp3. Pada larutan akuatik, kompleks oktaherdal, [Zn(H2O)6]2+, merupakan spesi yang dominan. Penguapan seng yang dikombinasikan dengan seng klorida pada temperatur di atas 285 °C mengindikasikan adanya Zn2Cl2 yang terbentuk, yakni senyawa seng yang berkeadaan oksidasi +1. Tiada senyawa seng berkeadaan oksidasi selain +1 dan +2 yang diketahui. Perhitungan teoritis mengindikasikan bahwa senyawa seng dengan keadaan oksidasi +4 sangatlah tidak memungkinkan terbentuk.
Sifat kimiawi seng mirip dengan logam-logam transisi periode pertama seperti nikel dan tembaga. Ia bersifat diamagnetik dan hampir tak berwarna. Jari-jari ion seng dan magnesium juga hampir identik. Oleh karenanya, garam kedua senyawa ini akan memiliki struktur kristal yang sama. Pada kasus di mana jari-jari ion merupakan faktor penentu, sifat-sifat kimiawi keduanya akan sangat mirip. Seng cenderung membentuk ikatan kovalen berderajat tinggi. Ia juga akan membentuk senyawa kompleks dengan pendonor N- dan S-. Senyawa kompleks seng kebanyakan berkoordinasi 4 ataupun 6 walaupun koordinasi 5 juga diketahui ada.
Senyawa seng
 |
| Seng klorida |
Kebanyakan metaloid dan non logam dapat membentuk senyawa biner dengan seng, terkecuali gas mulia. Oksida ZnO merupakan bubuk berwarna putih yang hampir tidak larut dalam larutan netral. Ia bersifat amfoter dan dapat larut dalam larutan asam dan basa kuat. Kalkogenida lainnya seperti ZnS, ZnSe, dan ZnTe memiliki banyak aplikasinya dalam bidang elektronik dan optik. Pniktogenida (Zn3N2, Zn3P2, Zn3As2 dan Zn3Sb2), peroksida ZnO2, hidrida ZnH2, dan karbida ZnC2 juga dikenal keberadaannya. Dari keempat unsur halida, ZnF2 memiliki sifat yang paling ionik, sedangkan sisanya (ZnCl2, ZnBr2, dan ZnI2) bertitik lebur rendah dan dianggap lebih bersifat kovalen.
 |
| Seng asetat basa |
Dalam larutan basa lemah yang mengandung ion Zn2+, hidroksida dari seng Zn(OH)2 terbentuk sebagai endapat putih. Dalam larutan yang lebih alkalin, hidroksida ini akan terlarut dalam bentuk [Zn(OH)4]2- Senyawa nitrat Zn(NO3)2, klorat Zn(ClO3)2, sulfat ZnSO4, fosfat Zn3(PO4)2, molibdat ZnMoO4, sianida Zn(CN)2, arsenit Zn(AsO2)2, arsenat Zn(AsO4)2•8H2O dan kromat ZnCrO4 merupakan beberapa contoh senyawa anorganik seng. Salah satu contoh senyawa organik paling sederhana dari seng adalah senyawa asetat Zn(O2CCH3)2.
Senyawa organoseng merupakan senyawa-senyawa yang mengandung ikatan kovalen seng-karbon. Dietilseng ((C2H5)2Zn)
merupakan salah satu reagen dalam kimia sintesis. Senyawa ini pertama
kali dilaporkan pada tahun 1848 dari reaksi antara seng dengan etil iodida dan merupakan senyawa yang pertama kali diketahui memiliki ikatan sigma logam-karbon. Dekametildizinkosena mengandung ikatan seng-seng kovalen yang kuat pada suhu kamar.
Peran hayati
Zink atau unsur seng memiliki peran fisiologi yang penting bagi
berbagai proses metabolisme. Peran yang umum adalah keterlibatan zink
sebagai kofaktor pada protein pengatur ekspresi gen dan sebagai enzim penyunting DNA. Kelas protein-protein yang menambat DNA dan memakai zink sebagai stabilisator ini dikenal sebagai protein jemari zink.
Defisiensi (kekurangan) zink memberi efek signifikan bagi tumbuhan.
Bagi tumbuhan darat, zink di tanah berperan sebagai hara mikro yang
penting dan diketahui 50% tanah pertanian dunia mengalami defisiensi
zink pada berbagai derajat. Pemupukan zink pada lahan demikian
memberikan efek yang signifikan. Gejala kekurangan zink pada tumbuhan
berbeda-beda, tetapi biasanya ditandai dengan kekerdilan dan daun yang
memiliki bagian yang tembus pandang, biasanya di pangkal daun. Pengujian tanah diperlukan untuk konfirmasi.
Manusia yang kekurangan zink mengalami gejala-gejala "hipozinkemia".
Orang yang mengalami kekurangan zink dapat terkena diare dan malfungsi
organ. Kemunduran dalam daya ingat dan reaksi indera juga terjadi.
Kemunculan jerawat
juga diketahui terkait dengan defisiensi zink. Ketombe dapat muncul
karena sel-sel kulit kekurangan zink. Zink diperlukan dalam produksi testosteron.
Penanganan
Seng tidak dianggap beracun, tetapi jika senyawa ZnO yang baru dibentuk terhirup, penyakit yang disebut oxide shakes atau zinc chills kadang-kadang bisa muncul. Perlu ventilasi yang cukup untuk ruangan yang menyimpan seng oksida untuk menghindari konsentrasi yang lebih dari 5 gram/m3 (dirata-ratakan berdasarkan berat untuk 8 jam pengeksposan, 40 jam per minggu).
Seng tidak dianggap beracun, tetapi jika senyawa ZnO yang baru dibentuk terhirup, penyakit yang disebut oxide shakes atau zinc chills kadang-kadang bisa muncul. Perlu ventilasi yang cukup untuk ruangan yang menyimpan seng oksida untuk menghindari konsentrasi yang lebih dari 5 gram/m3 (dirata-ratakan berdasarkan berat untuk 8 jam pengeksposan, 40 jam per minggu).













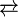 [Cr2O7]2- + H2O
[Cr2O7]2- + H2O